






《2019-2020学年新人教版必修1《1.3.3氧化还原反应的基本规律》PPT课件(106张)》是由用户上传到老师板报网,本为文库资料,大小为1.14 MB,总共有106页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 106页
- 1.14 MB
- VIP模板
- pptx
- 数字产品不支持退货
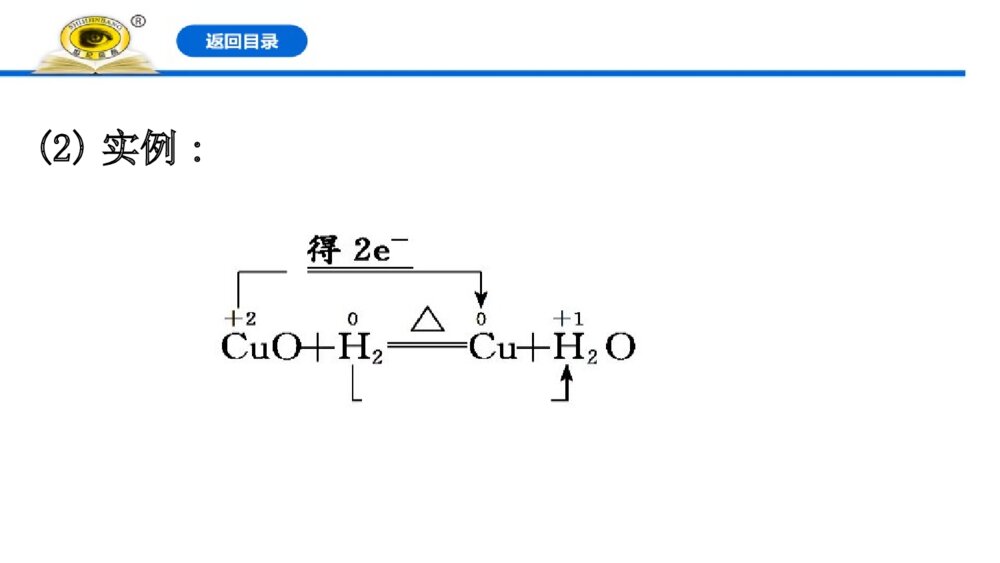
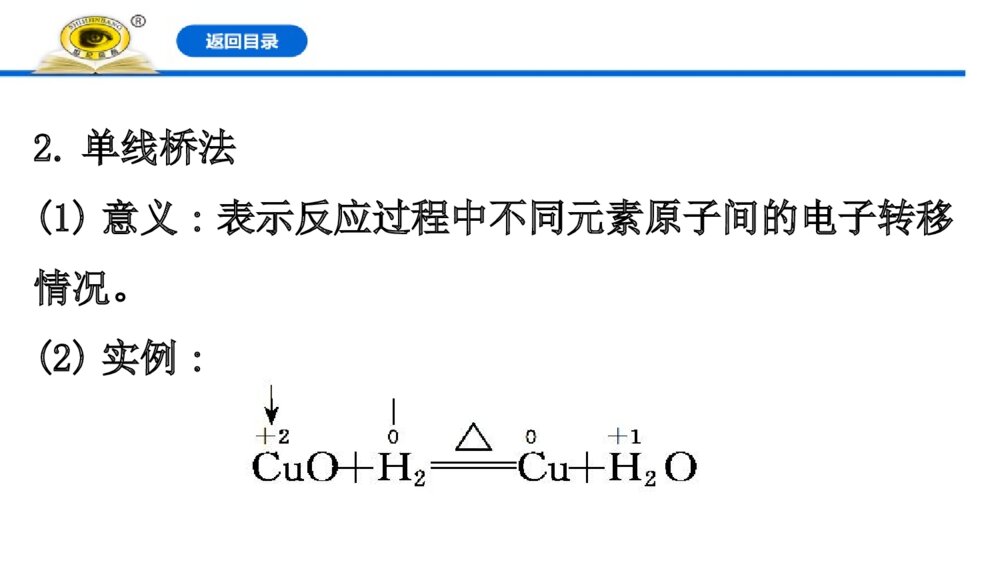
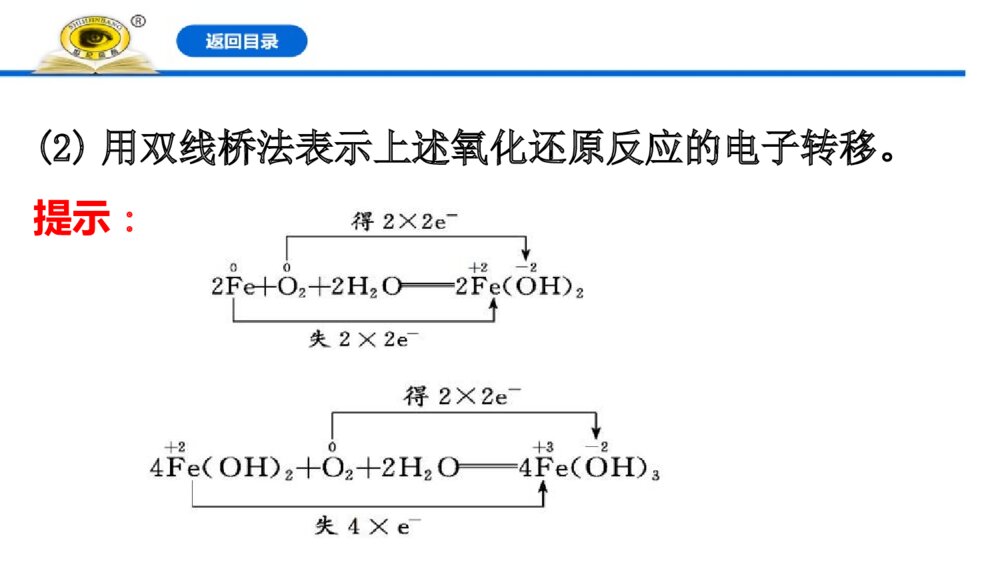
第3课时 氧化还原反应的基本规律 氧化还原反应电子转移的表示方法1.双线桥法(1)意义:表示反应前后同一元素由反应物转化为生成物时电子转移的情况。(2)实例:2.单线桥法(1)意义:表示反应过程中不同元素原子间的电子转移情况。(2)实例:【情境·思考】金属腐蚀,是金属和周围环境发生化学或电化学反应而导致的一种破坏性侵蚀,金属腐蚀现象十分普遍,如钢铁部件在潮湿环境中生锈,铜器在使用过程中表面生成铜绿,铝制品在潮湿空气中表面会生成白色粉末,地下金属管道腐蚀穿孔等。钢铁在潮湿环境下发生腐蚀的主要反应方程式为①2Fe+O2+2H2O====2Fe(OH)2,②4Fe(OH)2+O2+2H2O====4Fe(OH)3③2Fe(OH)3====Fe2O3·xH2O+(3-x)H2O(1)上述过程发生的反应中属于氧化还原反应的有哪些反应?提示:①②。氧化还原反应的特征是化合价的升降。(2)用双线桥法表示上述氧化还原反应的电子转移。提示:知识点一 氧化还原反应中电子转移的表示方法【重点释疑】1.双线桥法(1)基本步骤(2)注意事项①箭头、箭尾必须对应化合价变化的同种元素的原子;②必须注明“得到”或“失去”;③电子转移数用a×be-形式表示,a表示发生氧化或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略。④被还原的物质和被氧化的物质得、失电子数守恒。如(3)记忆口诀:先标化合价,再看价变化;起止同元素,桥上标变化。2.单线桥法(1)基本步骤(2)注意事项①不需要标明“得到”或“失去”,只标明电子转移数目;②要用箭头标明电子转移的方向;③箭头由反应物中失电子元素原子指向得电子元素原子。如【记忆口诀】先确定变价元素,再计算价态变化;桥上标明电子数,箭头还原到氧化。 【思考·讨论】(1)在用双线桥法表示电子转移情况时,箭头的指向能表示电子转移的方向吗?两个线桥上表示的电子总数有何关系?请简要说明。提示:双线桥不能表示电子转移方向;只能表明同一元素原子的电子转移情况。两个线桥上电子总数相等。(2)在用单线桥法表示电子转移情况时,其含义是什么?提示:单线桥法箭头指向为从还原剂到氧化剂及它们之间转移的电子数。【案例示范】【典例】(2019·海淀高一检测)碘缺乏病是机体因缺碘导致的疾病,即地方性甲状腺肿大和地方性克汀病,主要病因是环境缺碘,人体摄取碘不足所致。我国政府对碘缺乏病相当重视,为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可用如下反应:KIO3+5KI+3H2SO4====3K2SO4+3I2+3H2O(1)请指出该反应的氧化剂、还原剂、氧化产物、还原产物。(2)请分别用单线桥法和双线桥法标出该反应电子转移的方向和数目。(3)不法商贩为贪图盈利,制售假盐,假盐中不含碘,请利用家庭生活用品,设计实验,检验食用盐中是否含有碘元素,将你的思路写出来,与同学们交流。(4)请查阅相关资料,写出几条防治碘缺乏病的措施。答案:(1)氧化剂是KIO3,还原剂是KI,氧化产物、还原产物均是I2。(2)双线桥:单线桥:(3)在酸性条件下能将I-氧化成I2,I2遇淀粉试液变蓝;而不加碘的食盐则不能发生类似的反应。(4)①食用合格碘盐,②经常吃含碘丰富的食物:紫菜、海带、海鱼及海贝类等。3IO3IO 【迁移·应用】(2019·衡水高一检测)黑火药是中国的四大发明之一,发生爆炸的原理如下:S+2KNO3+3CK2S+N2↑+3CO2↑(1)用双线桥法分析以上反应并注明电子得失_____。 (2)该反应中氧化剂是_______;还原产物是_______。 【解析】(1)解题时首先找出变价元素,确定其升降规律,然后依据得失电子数目相等的规律,标出电子转移的数目,如下:(2)元素化合价降低的物质是氧化剂;氧化剂被还原为还原产物,故S和KNO3是氧化剂,K2S和N2是还原产物。答案:(1)(2)S、KNO3 K2S、N2【补偿训练】 1.(2019·漳州高一检测)下列反应中,电子转移方向和数目正确的是( )【解析】选D。选项A中应该转移2个电子;选项B中是亚铁离子被氧化为铁离子,失去电子;选项C中,C失去电子,氧气得到电子。2.实验室里迅速制备少量氯气可利用以下反应:2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O。(1)用双线桥法表示出电子转移情况:2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O。(2)用单线桥法表示出电子转移情况:2KMnO4+16HCl(浓)====2KCl+2MnCl2十5Cl2↑+8H2O。(3)该反应中氧化剂是________________,发生氧化反应的是________________。【解析】反应中锰元素化合价由+7价降低到+2价,氯元素由-1价升高到氯气中的0价,高锰酸钾是氧化剂,发生还原反应,盐酸作还原剂,发生氧化反应,结合氧化还原反应中电子转移的两种表示方法画出双线桥和单线桥。答案:(1)(2)(3)KMnO4 HCl 知识点二 氧化还原反应的基本规律【重点释疑】1.守恒规律应用:氧化还原反应方程式的配平和相关计算。2.强弱规律还原性:还原剂>还原产物。氧化性:氧化剂>氧化产物。应用:物质间氧化性(或还原性)的强弱比较或判断氧化剂和有还原性的物质在一定条件下是否发生反应。3.先后规律(1)同一氧化剂与多种还原剂混合,还原性强的先被氧化。(2)同一还原剂与多种氧化剂混合,氧化性强的先被还原。应用:判断物质的氧化性、还原性强弱或判断反应的先后顺序。如:把氯气通入FeBr2溶液时,还原性:Fe2+>Br-,若氯气的量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,还原性:I->Fe2+,若氯气的量不足时首先氧化I-。4.价态规律(1)高低规律应用:判断物质的氧化性、还原性。(2)归中规律①同种元素不同价态之间发生氧化还原反应时,高价态+低价态中间价态,即“价态归中,互不交叉”,三种情况:②同种元素相邻价态间不发生化学反应。应用:判断同种元素不同价态的物质间发生氧化还原反应的可能性。(3)歧化规律同种元素的中间价态生成高价和低价,即中间价高价+低价。 【思考·讨论】 (1)把少量铁粉加入硝酸铜和硝酸银的混合溶液中,结果只有银白色物质析出,你能解释其中的道理吗?提示:氧化性Ag+>Cu2+,根据先后规律,少量的铁先与氧化性强的Ag+发生反应,结果只有银白色物质析出。(2)已知SO2具有较强的还原性,浓硫酸具有吸水性和强氧化性,那么能否使用浓硫酸干燥SO2?提示:能。硫元素的化合价有-2、0、+4、+6,SO2和浓硫酸中硫元素的化合价分别为+4、+6,中间没有价态,不能发生氧化还原反应,故可以干燥。【案例示范】【典例1】一定条件下,氨气与一氧化氮发生反应:NH3+NON2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为( )A.2∶3 B.3∶2 C.4∶5 D.5∶6【解析】选A。在氧化还原反应中,得失电子数目相等。NH3中N的化合价为-3,反应后变为0,作还原剂被氧化;NO中N的化合价为+2,反应后为0,作氧化剂被还原。为保持得失电子数目相等,则应为2个NH3和3个NO反应,所以被氧化与被还原的氮原子的原子个数比为2∶3。 【母题追问】(1)氧化产物与还原产物的分子个数之比是多少?提示:2∶3。氮气既是氧化产物也是还原产物,即被氧化与被还原氮原子数之比。(2)氧化剂与还原剂的分子个数之比是多少?提示:3∶2。氧化剂、还原剂分别是NO、NH3,根据电子守恒知:N(NO)×2=N(NH3)×3,则N(NO)∶N(NH3)=3∶2。【典例2】在常温下发生下列反应:①16H++10Z-+2====2X2++5Z2+8H2O②2A2++B2====2A3++2B-③2B-+Z2====B2+2Z-根据上述反应,判断下列结论中错误的是( )4XO4XOA.溶液中可能发生反应Z2+2A2+====2A3++2Z-B.Z2在①③反应中作还原剂C.氧化性强弱顺序为>Z2>B2>A3+D.X2+是的还原产物4XO4XO4XO4XO【解析】选B。①16H++10Z-+2====2X2++5Z2+8H2O中,Z元素的化合价升高,X元素的化合价降低;②2A2++B2====2A3++2B-中,A元素的化合价升高,B元素的化合价降低;③2B-+Z2====B2+2Z-中,B元素的化合价升高,Z元素的化合价降低。氧化剂的氧化性大于氧化产物的氧化性,则氧化性>Z2>B2>A3+,可发生反应Z2+2A2+4XO4XO4XO4XO====2A3++2Z-,氧化性Z2>A3+,A、C正确;①中Z元素的化合价升高,③中Z元素的化合价降低,分别作还原剂、氧化剂,B错误;①中X得到电子被还原,则X2+是的还原产物,D正确。4XO4XO 【迁移·应用】1.(2019·武威高一检测)下列微粒中,只有氧化性的是( )①S2- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦MgA.①⑦B.②④C.③⑤⑥D.②④⑤⑥【解析】选C。元素在最高价时只有氧化性。S2-为最低价,Fe2+是中间价态,Fe3+是最高价,S在中间价态,H+为最高价,Na+是最高价,Mg为最低价。2.(2015·梅州高一检测)已知氧化性:Cl2>Fe3+>S,则下列说法正确的是( )A.Fe可以和S在加热条件下生成Fe2S3B.Cl2和H2S相遇可发生反应:H2S+Cl2===2HCl+S↓C.在酸性溶液中,Fe3+和S2-可以大量共存D.Cl2可以氧化Fe3+【解析】选B。A项反应若发生则有氧化性S>Fe3+,与题干矛盾,A错误;C项Fe3+可以氧化S2-;D项中Fe3+已是最高价,没有还原性,不能被Cl2氧化。3.在反应3NO2+H2O====2HNO3+NO中,发生还原反应和发生氧化反应的分子个数之比为( )A.3∶1B.1∶3C.1∶2D.2∶1【解析】选C。根据反应3+H2O====2+知,11发生还原反应,22发生氧化反应,故发生还原反应和发生氧化反应的分子个数之比为1∶2。42NO53HNO2NO42NO2NO42NO53HNO42NO53HNO2NO42NO2NO42NO53HNO【补偿训练】(2019·焦作高一检测)在反应3S+6KOH====2K2S+K2SO3+3H2O中,被还原的硫与被氧化的硫的质量比为( )A.2∶1B.1∶2C.3∶1D.1∶3【解析】选A。被还原的硫在反应中作氧化剂,化合价降低,被氧化的硫在反应中作还原剂,化合价升高,反应中3个硫原子有2个化合价降低,1个化合价升高,故被还原的硫与被氧化的硫的质量比为2∶1。【素养提升】“84”消毒液和洁厕灵是家庭必备的生活用品。84消毒液是一种高效消毒剂,主要成分为次氯酸钠(NaClO,Cl为+1价)是无色或淡黄色液体,且具有刺激性气味。被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。洁厕灵主要成分是盐酸,还有微量表面活性剂、香精、缓蚀剂、助剂。主要应用在家庭、宾馆、饭店、学校、医院、公厕、移动厕所等场所。(1)利用氧化还原反应的知识从氯元素的角度分析“84”消毒液和洁厕灵的主要成分具有哪些性质?提示:NaClO中Cl为+1价,处于氯的中间价态,既有氧化性又有还原性;HCl中Cl为-1价,处于氯的最低价态,只有还原性。(2)“84”消毒液和洁厕灵不能混用,混用常常会发生中毒现象(已知氯气有毒)。①利用氧化还原反应的原理说明原因。提示:NaClO既有氧化性又有还原性,HCl具有还原性,两者混用会发生归中反应生成有毒气体Cl2。②写出反应的化学方程式,并分别用单线桥法、双线桥法表示电子转移。提示:知识点三 氧化还原反应的配平与计算【重点释疑】1.氧化还原反应方程式的配平(1)配平三原则:(2)配平五步骤:一般氧化还原反应方程式的配平方法——化合价升降法(3)示例:分析并配平化学方程式:第三步:求总数,从而确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数 故H2S的化学计量数为3,HNO3的化学计量数为2。第四步:配系数,先配平变价元素,再利用原子守恒配平其他元素。3H2S+2HNO3====3S↓+2NO+4H2O第五步:查守恒,其他原子在配平时相等,最后利用氧原子守恒来进行验证。2.有关氧化还原反应的计算(1)原则:电子守恒——反应中氧化剂得到的电子总数与还原剂失去的电子总数相等,即得失电子守恒。(2)解题思维流程①找物质:分析反应前后元素化合价的变化,确定氧化剂、还原剂及相应的还原产物、氧化产物。②定得失:确定一个原子(或离子)得失电子数(注意化学式中原子的个数)。③列等式:根据已知化学计量数及电子得失守恒列出等式,N(氧化剂)×变价原子个数×化合价变化值(高价-低价)=N(还原剂)×变价原子个数×化合价变化值(高价-低价)。④找关系:对于多步连续进行的氧化还原反应,若中间各步反应过程中无损耗,可直接根据电子得失守恒建立起始反应物和最终生成物的关系,快速列式求解。(3)常见题型①求氧化剂与还原剂的粒子数之比或质量之比。②计算参加反应的氧化剂或还原剂的量。③确定反应前后某一元素价态的变化。 【思考·讨论】(1)1分子Cl2与足量NaOH溶液发生反应Cl2+2NaOH====NaClO+NaCl+H2O,转移电子数是多少?提示:1个。反应中一半Cl2化合价升高,一半化合价降低。(2)Na2SO3与KMnO4按个数5∶2完全反应,你能确定还原产物中被还原元素的价态吗?提示:+2。5×(6-4)=2×(7-x),解得x=2,即还原产物中被还原元素的化合价为+2。【案例示范】【典例1】配平下列化学方程式:【解析】按照“标→等→定→平→查”的步骤,根据电子守恒、原子守恒、电荷守恒配平。要关注(1)中的酸除作氧化剂外,还起到酸的作用。答案:(1)3 8 3 2 4(2)5 1 3 3 3 3 (3)2 16 10 2 5 8【规律方法】氧化还原反应方程式配平的几种方法(1)正向配平法:若参加反应的氧化剂全部被还原,参加反应的还原剂全部被氧化,可采用正向配平法,即根据化合价升降总数相等,确定氧化剂和还原剂的化学计量数,然后用观察法配平其他物质。(2)逆向配平法:部分氧化还原反应、自身氧化还原反应等宜选用逆向配平法,即先确定氧化产物和还原产物的化学计量数,然后用观察法确定氧化剂和还原剂的化学计量数。(3)双向配平法:若氧化剂(或还原剂)中某元素的化合价只有部分发生变化,配平要从还原剂、还原产物(氧化剂、氧化产物)着手,即从化学方程式的两端进行配平。【典例2】Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的个数之比为1∶16,则x的值为( ) A.2B.3C.4D.5【思维建模】解答有关氧化还原反应计算题目的思维流程如下:【解析】选D。本题考查在氧化还原反应中利用得失电子守恒进行相关的计算。得关系式1×[6-(-)]·x=16×2x=5。2611xx224NaSxNaSONaClONaCl2x2611xx224NaSxNaSONaClONaCl2x 【迁移·应用】1.(2019·柳州高一检测)已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-====2+3Cl-+5H2O。则中R的化合价是( ) A.+3B.+4C.+5D.+6n4ROn4ROn4ROn4RO【解析】选D。根据离子反应中反应前后电荷守恒,可得3+4=2n+3,解得n=2,根据化合价规则判断中R的化合价为+6价。24RO24RO2.配平下列方程式和离子方程式:【解析】按照“标→等→定→平→查”的步骤,根据电子守恒、原子守恒、电荷守恒配平。反应中氧化剂还原剂是一种物质时,该类反应可以采用逆向配平法。答案:(1)3 6 2 1 3 (2)2 9 3 3 5(3)5 4 1 1 2【补偿训练】1.(2019·聊城高一检测)在酸性条件下,可发生如下反应:+2M3++4H2O====+Cl-+8H+,中M的化合价是( ) A.+4B.+5C.+6D.+73ClO-n27MO-n27MO-3ClO-n27MO-n27MO-【解析】选C。根据电子守恒得:设M的化合价是x,则6=2(x-3),x=+6。2.若锌与稀硝酸反应时,其化学反应方程式为4Zn+10HNO3====aZn(NO3)2+bM+cH2O,则a、b、c、M可能分别为( )A.4、5、5、NO2B.4、2、4、NO2C.4、1、3、NH4NO3D.4、3、5、NO【解析】选C。由反应可知,锌元素的化合价升高,则氮元素的化合价降低,①若M为NO2,由得失电子守恒可知,b==8,A、B错误;②若M为NO,由得失电子守恒可知,b=,D错误;③若M为NH4NO3,由得失电子守恒可知,b==1,结合原子守恒可知,a=4,c=3。420544208523=42053420544208523=42053【素养提升】氰化钠是一种重要的基本化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理方面。氰化钠有剧毒,皮肤伤口接触、吸入、吞食微量可中毒死亡。(1)NaCN(N为-3价)属于剧毒物质,可用H2O2进行无害化处理:NaCN+H2O2N2↑+X+H2O。X的化学式是什么?(2)TiO2作催化剂,用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。写出CNO-在酸性条件下被NaClO氧化的离子方程式。【解析】(1)根据氧化还原反应中得失电子守恒和原子守恒可以推出X为NaHCO3。(2)CNO-在酸性条件下与NaClO反应生成N2、CO2、Cl2,根据元素守恒可知还有H2O生成,结合原子守恒、得失电子守恒和电荷守恒可写出该离子方程式。答案:(1)NaHCO3(2)2CNO-+6ClO-+8H+====N2↑+2CO2↑+3Cl2↑+4H2O【课堂回眸】



















